アロカリス点滴静注235㎎という薬剤が販売されましたが、この薬剤を深堀りしていきたいと思います。
- 効能効果「 抗悪性腫瘍剤(シスプラチン等)投与に伴う消化器症状(悪心、嘔吐)(遅発期を含む)」
- アロカリスは、本邦で2剤目の選択的NK1受容体拮抗型制吐剤です。
- アロカリスはホスアプレピタントと比較して遅発後期の制吐効果に優れるとの意見もあるが、統計的には非劣勢である(ただし傾向は認められる)
- アロカリスはホスアプレピタントと比較して注射部位反応の発生率は0.3%(1/392)とアプレピタント(3.6%)よりも低い
- アロカリスはパロノセトロンと混合して投与することが可能なため、投与の時間短縮のメリットがある。(一方、ホスアプレピタントはパロノセトロンと3時間で配合変化が確認されており、配合不可))
- 日本のガイドラインには未掲載であるが、ASCOのガイドラインではNK1受容体拮抗薬の一つとしてホスアプレピタントと同列で紹介されている
- 仮に同効薬の「ホスアプレピタント」の後発品からアロカリスへ切り替えた場合、薬剤コスト増となる可能性が高い
![]() 監修薬剤師
監修薬剤師

✅ 日本で約50人しかいない最難関の指導薬剤師に最速で認定
✅ 医師からの薬の相談件数:年間約1,000件
✅ 当サイトで解説している市販薬の販売実績:2,700件以上
目次・・・
作用機序は?
「アロカリス」の作用機序は選択的NK1受容体拮抗型の制吐剤です。
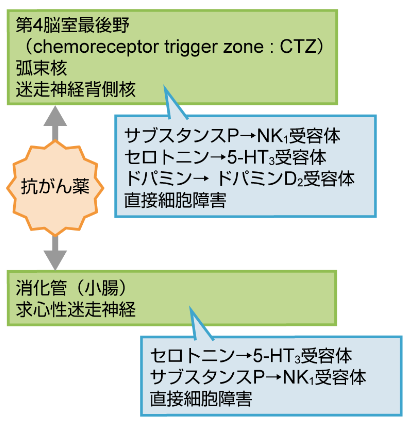
アロカリスの類似薬は?
アロカリスと同じ作用機序の薬剤はこのようになっています。
| 商品名 | アロカリス | イメンド | プロイメンド |
| 一般名 | ホスネツピタント | アプレピタント | ホスアプレピタント |
| 使用可能年齢 | 成人 | 生後6か月以上 | 12歳以上 |
使用可能となっている年齢が異なることに注意が必要です。
ホスアプレピタント(プロイメンド)との比較臨床試験
アロカリスはホスアプレピタント(プロイメンド)との類似薬ですが、上記以外にも違いがありますのでまとめます。
アロカリスにデキサメタゾンを併用するときの減量はホスアプレピタントと同等
ホスアプレピタントはデキサメタゾンの血中濃度を上昇させることが知られています。
the AUC of oral dexamethasone (20 mg day 1 and 8 mg days 2 to 5) was increased 2-fold when coadministered with
参考:uptodate
aprepitant (125 mg day 1 and 80 mg days 2 to 5)
ですので、ホスアプレピタントにデキサメタゾンを併用するときは、大体50%ほど減量して使用することが多いです。
ではアロカリスにデキサメタゾンを併用する場合はどうかと言うとやはり同じように半分に減量すればよいと考えられます。
理由は、アロカリスもデキサメタゾンの血中濃度を2倍以上増加させることが知られているからです。
![]() netupitant (single dose of 100 mg, 300 mg, or 450 mg) increased the exposure to dexamethasone (20 mg on day 1, 8 mg twice daily on days 2 to 4) in a dose- and time-dependent manner.1,2 With coadministration of 100 mg, 300 mg, or 450 mg of netupitant, the dexamethasone AUC on day 1 increased 48%, 72%, and 75%, respectively. The AUC on day 2 increased 109%, 143%, and 158%, respectively, and the AUC on day 4 increased 75%, 140%, and 170%, respectively
netupitant (single dose of 100 mg, 300 mg, or 450 mg) increased the exposure to dexamethasone (20 mg on day 1, 8 mg twice daily on days 2 to 4) in a dose- and time-dependent manner.1,2 With coadministration of 100 mg, 300 mg, or 450 mg of netupitant, the dexamethasone AUC on day 1 increased 48%, 72%, and 75%, respectively. The AUC on day 2 increased 109%, 143%, and 158%, respectively, and the AUC on day 4 increased 75%, 140%, and 170%, respectively
それを踏まえて、比較臨床試験では、デキサメタゾンの用量はアロカリスもホスアプレピタントも同量のデキサメタゾン投与量で試験をしているからです。
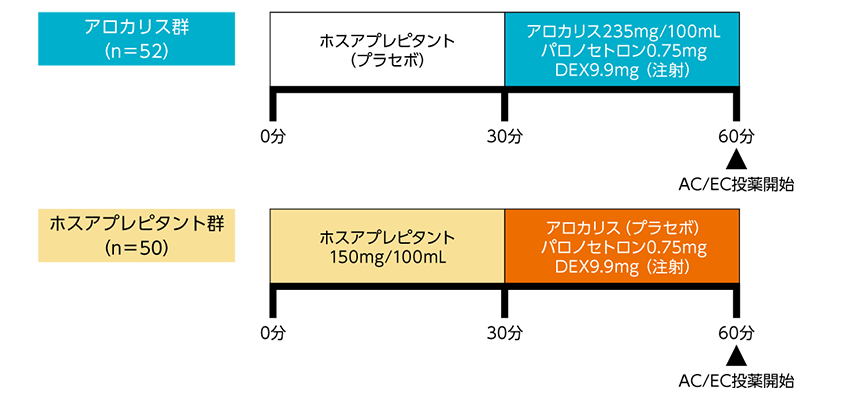
参考:J Clin Onco. 2022 Jan 10;40(2):180-188. doi: 10.1200/JCO.21.01315.https://ascopubs.org/doi/full/10.1200/JCO.21.01315
注射部位反応はアロカリスでは起こりにくい
注射部位反応の発生率はアロカリスが0.3%(1/392)でアプレピタント(3.6%)とのデータがあります。
参考:J Clin Oncol. 2022;40(2):180. Epub 2021 Nov 18
アロカリスの配合変化は?(アプレピタントとの比較)
アロカリスはパロノセトロンと混合して投与することが可能です。しかし、まったく配合変化を起こさないわけではなく「多くの薬を配合変化を起こします」ので注意してください。※アロカリス配合変化表より⇓
| 配合薬剤名 | 製造販売元 | 単位/容量 (希釈液量) |
測定項目 | 測定時期 | ||||||
| 開始時(直後) | 30 分 | 1 時間 | 2 時間 | 3 時間 | 6 時間 | 24 時間 | ||||
| 硫酸 Mg 補正液 1mEq/mL |
大塚製薬工 場 | 2.46g/20mL +Sal. 50mL |
外観 | 白色懸濁 | - | - | - | - | - | - |
| pH | 7.22 | - | - | - | - | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| 硫酸 Mg 補正液 1mEq/mL |
大塚製薬工 場 | 2.46g/20mL +Sal. 250mL |
外観 | 白色懸濁 | - | - | - | - | - | - |
| pH | 7.16 | - | - | - | - | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| 硫酸 Mg 補正液 1mEq/mL |
大塚製薬工 場 | 2.46g/20mL +Sal. 500mL +Sal. 50mL |
外観 | 白色懸濁 | - | - | - | - | - | - |
| pH | 7.22 | - | - | - | - | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| 硫酸 Mg 補正液 1mEq/mL |
大塚製薬工 場 | 2.46g/20mL +Sal. 500mL +Sal. 250mL |
外観 | 無色澄明 | - | - | - | 白色懸濁 | - | - |
| pH | 7.23 | - | - | - | 7.21 | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| 硫酸 Mg 補正液 1mEq/mL |
大塚製薬工 場 | 2.46g/20mL +3A. 500mL +Sal. 50mL |
外観 | 無色澄明 | - | - | - | 白色懸濁 | - | - |
| pH | 6.29 | - | - | - | 6.30 | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| 硫酸 Mg 補正液 1mEq/mL |
大塚製薬工 場 | 2.46g/20mL +3A. 500mL +Sal. 250mL |
外観 | 無色澄明 | - | - | - | 無色、白色析出 | - | - |
| pH | 6.27 | - | - | - | 6.28 | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| 硫酸 Mg 補正液 1mEq/mL |
大塚製薬工 場 | 2.46g/20mL +Sal. 500mL +Sal. 250mL |
外観 | 無色澄明 | 白色懸濁 | - | - | - | - | - |
| pH | 7.29 | 7.29 | - | - | - | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| 硫酸 Mg 補正液 1mEq/mL |
大塚製薬工 場 | 2.46g/20mL +3A. 500mL +Sal. 50mL |
外観 | 無色澄明 | 無色、白色析出 | - | - | - | - | - |
| pH | 6.19 | 6.18 | - | - | - | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| 硫酸 Mg 補正液 1mEq/mL |
大塚製薬工 場 | 2.46g/20mL +3A. 500mL +Sal. 250mL |
外観 | 無色澄明 | 無色澄明 | 無色澄明 | 無色、白色析出 | - | - | - |
| pH | 6.24 | 6.25 | 6.25 | 6.26 | - | - | - | |||
| 定量法(%)* | - | 97.9 | 99.1 | - | - | - | - | |||
| 静注用マグネゾール 20mL |
あすか製 薬 | 2g/20mL +Sal. 50mL |
外観 | 白色懸濁 | - | - | - | - | - | - |
| pH | 7.16 | - | - | - | - | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| 静注用マグネゾール 20mL |
あすか製 薬 | 2g/20mL +Sal. 250mL |
外観 | 白色懸濁 | - | - | - | - | - | - |
| pH | 7.03 | - | - | - | - | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| 静注用マグネゾール 20mL |
あすか製 薬 | 2g/20mL +Sal. 500mL +Sal. 50mL |
外観 | 白色懸濁 | - | - | - | - | - | - |
| pH | 7.02 | - | - | - | - | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| 静注用マグネゾール 20mL |
あすか製 薬 | 2g/20mL +Sal. 500mL +Sal. 250mL |
外観 | 無色澄明 | - | - | - | 白色懸濁 | - | - |
| pH | 7.05 | - | - | - | 7.12 | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| 静注用マグネゾール 20mL |
あすか製 薬 | 2g/20mL +3A. 500mL +Sal. 50mL |
外観 | 無色澄明 | - | - | - | 無色、白色析出 | - | - |
| pH | 6.23 | - | - | - | 6.25 | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| 静注用マグネゾール 20mL |
あすか製 薬 | 2g/20mL +3A. 500mL +Sal. 250mL |
外観 | 無色澄明 | - | - | - | 無色、白色析出 | - | - |
| pH | 6.19 | - | - | - | 6.18 | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| 静注用マグネゾール 20mL |
あすか製 薬 | 2g/20mL +Sal. 500mL +Sal. 250mL |
外観 | 無色澄明 | 白色懸濁 | - | - | - | - | - |
| pH | 6.83 | 7.09 | - | - | - | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| 静注用マグネゾール 20mL |
あすか製 薬 | 2g/20mL +3A. 500mL +Sal. 50mL |
外観 | 無色澄明 | 無色澄明 | 無色、白色析出 | - | - | - | - |
| pH | 6.11 | 6.11 | 6.12 | - | - | - | - | |||
| 定量法(%)* | - | 58.7 | - | - | - | - | - | |||
| 静注用マグネゾール 20mL |
あすか製 薬 | 2g/20mL +3A. 500mL +Sal. 250mL |
外観 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | - | - | - |
| pH | 6.17 | 6.14 | 6.13 | 6.14 | - | - | - | |||
| 定量法(%)* | - | 100.4 | 100.0 | 87.2 | - | - | - | |||
| カルチコール注射液 8.5% 10mL |
日医工 | 850mg/10mL +Sal. 50mL |
外観 | 白色懸濁 | - | - | - | - | - | - |
| pH | 7.56 | - | - | - | - | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| カルチコール注射液 8.5% 10mL |
日医工 | 850mg/10mL +Sal. 250mL |
外観 | 無色、白色析出 | - | - | - | - | - | - |
| pH | 7.41 | - | - | - | - | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| 大塚塩カル注 2% | 大塚製薬工 場 | 0.53g/20mL +Sal. 50mL |
外観 | 白色懸濁 | - | - | - | - | - | - |
| pH | 7.34 | - | - | - | - | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| 大塚塩カル注 2% | 大塚製薬工 場 | 0.53g/20mL +Sal. 250mL |
外観 | 白色懸濁 | - | - | - | - | - | - |
| pH | 7.37 | - | - | - | - | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| アスパラカリウム注 10mEq |
ニプロ | 1.712g/10mL +Sal. 50mL |
外観 | 無色澄明 | - | - | - | 無色澄明 | 無色澄明 | 無色澄明 |
| pH | 7.33 | - | - | - | 7.32 | 7.31 | 7.27 | |||
| 定量法(%)* | - | - | - | - | 100.0 | 99.2 | 99.2 | |||
| アスパラカリウム注 10mEq |
ニプロ | 1.712g/10mL +Sal. 250mL |
外観 | 無色澄明 | - | - | - | 無色澄明 | 無色澄明 | 無色澄明 |
| pH | 7.27 | - | - | - | 7.27 | 7.26 | 7.20 | |||
| 定量法(%)* | - | - | - | - | 101.3 | 100.0 | 100.4 | |||
| アスパラカリウム注 10mEq |
ニプロ | 1.712g/10mL +Sal. 500mL +Sal. 50mL |
外観 | 無色澄明 | - | - | - | 無色澄明 | 無色澄明 | 無色澄明 |
| pH | 7.18 | - | - | - | 7.16 | 7.15 | 7.11 | |||
| 定量法(%)* | - | - | - | - | 100.4 | 100.0 | 99.6 | |||
| アスパラカリウム注 10mEq |
ニプロ | 1.712g/10mL +Sal. 500mL +Sal. 250mL |
外観 | 無色澄明 | - | - | - | 無色澄明 | 無色澄明 | 無色澄明 |
| pH | 7.13 | - | - | - | 7.14 | 7.12 | 7.10 | |||
| 定量法(%)* | - | - | - | - | 100.0 | 99.6 | 100.0 | |||
| アイソボリン点滴静注用 25mg×16 | ファイザー | 400mg +5D. 250mL +Sal. 50mL |
外観 | 無色澄明 | 白色懸濁 | - | - | - | - | - |
| pH | 7.17 | 7.25 | - | - | - | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| アイソボリン点滴静注用 25mg×16 | ファイザー | 400mg +5D. 250mL +Sal. 250mL |
外観 | 無色澄明 | 白色懸濁 | - | - | - | - | - |
| pH | 7.26 | 7.16 | - | - | - | - | - | |||
| 定量法(%)* | - | - | - | - | - | - | - | |||
| アイソボリン点滴静注用 25mg×16 | ファイザー | 400mg +Sal. 500mL +Sal. 50mL |
外観 | 無色澄明 | 無色澄明 | - | - | - | - | - |
| pH | 7.56 | 7.46 | - | - | - | - | - | |||
| 定量法(%)* | - | 100.0 | - | - | - | - | - | |||
| アイソボリン点滴静注用 25mg×16 | ファイザー | 400mg +Sal. 500mL +Sal. 250mL |
外観 | 無色澄明 | 無色澄明 | - | - | - | - | - |
| pH | 7.46 | 7.46 | - | - | - | - | - | |||
| 定量法(%)* | - | 99.6 | - | - | - | - | - | |||
| 大塚生食注 | 大塚製薬工場 | 50mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.38 | - | - | 8.26 | 8.18 | 8.21 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 99.1 | 97.7 | ||||
| 大塚生食注 | 大塚製薬工場 | 250mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.03 | - | - | 8.01 | 7.98 | 7.88 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 97.8 | ||||
| KN1 号輸液 | 大塚製薬工場 | 200mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.92 | - | - | 7.99 | 7.96 | 7.92 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 98.7 | 100.0 | ||||
| KN3 号輸液 | 大塚製薬工場 | 200mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.41 | - | - | 6.44 | 6.44 | 6.44 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 99.1 | 99.6 | ||||
| ソリタ-T1 号輸液 | エイワイファーマ | 200mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.64 | - | - | 6.70 | 6.72 | 6.71 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.1 | 99.6 | ||||
| ソリタ-T2 号輸液 | エイワイファーマ | 200mL | 性状 | 無色澄明* | 無色澄明 | 無色澄明 | 白色懸濁 | - | - | |
| pH | 5.21* | 5.22 | 5.21 | 5.47 | - | - | ||||
| 残存率(%) | 100.0 | 100.5 | 100.0 | - | - | - | ||||
| ソリタ-T3 号輸液 | エイワイファーマ | 200mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.60 | - | - | 6.64 | 6.62 | 6.65 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.9 | ||||
| ソルデム 1 輸液 | テルモ | 200mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.58 | - | - | 7.58 | 7.57 | 7.52 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.1 | 99.6 | ||||
| ソルデム 3A 輸液 | テルモ | 200mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.51 | - | - | 7.51 | 7.49 | 7.43 | ||||
| 残存率(%) | 100.0 | - | - | 98.7 | 98.7 | 99.1 | ||||
| ソルデム 3AG 輸液 | テルモ | 200mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.31 | - | - | 7.33 | 7.39 | 7.33 | ||||
| 残存率(%) | 100.0 | - | - | 99.1 | 99.6 | 98.7 | ||||
| ソルデム 3PG 輸液 | テルモ | 200mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.89 | - | - | 5.90 | 5.90 | 5.90 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 100.4 | ||||
| ハルトマン-G3 号輸液 | 共 和 クリティケア |
200mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.98 | - | - | 6.02 | 6.02 | 6.10 | ||||
| 残存率(%) | 100.0 | - | - | 96.2 | 96.6 | 95.3 | ||||
| フィジオ 35 輸液 | 大塚製薬工場 | 250mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 白色懸濁 | |
| pH | 5.07 | - | - | 5.07 | 5.08 | 5.12 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 94.2 | - | ||||
| 大塚糖液 5% | 大塚製薬工場 | 100mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.35 | - | - | 8.50 | 8.51 | 8.45 | ||||
| 残存率(%) | 100.0 | - | - | 100.5 | 100.5 | 101.4 | ||||
| 20%マンニットール注射液「YD」 | 陽進堂 | 300mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 析出物あり | |
| pH | 8.40 | - | - | 8.43 | 8.44 | 8.48 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.4 | - | ||||
| ラクテック注 | 大塚製薬工場 | 250mL | 性状 | 無色澄明 | 無色澄明 | 白色懸濁 | - | - | - | |
| pH | 7.67 | 7.62 | 7.48 | - | - | - | ||||
| 残存率(%) | 100.0 | 100.5 | - | - | - | - | ||||
| ラクテック G 輸液 | 大塚製薬工場 | 250mL | 性状 | 無色澄明* | 無色澄明 | 無色澄明 | 析出物あり | - | - | |
| pH | 7.49* | 7.56 | 7.49 | 7.39 | - | - | ||||
| 残存率(%) | 100.0 | 100.0 | 99.5 | - | - | - | ||||
| ソリューゲン F 注 | 共 和 クリティケア |
500mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.17 | - | - | 7.16 | 7.07 | 7.03 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 99.6 | 99.6 | ||||
| ソルアセト F 輸液 | テルモ | 500mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.03 | - | - | 7.04 | 7.01 | 6.91 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 100.4 | 99.6 | ||||
| ビーフリード輸液 | 大塚製薬工場 | 500mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.80 | - | - | 6.76 | 6.77 | 6.72 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| アタラックス-P注射液 (50mg/mL) |
ファイザー | 50mg/mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.97 | - | - | 6.97 | 6.97 | 6.96 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 98.7 | ||||
| アタラックス-P注射液 (50mg/mL) |
ファイザー | 50mg/mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.97 | - | - | 6.97 | 6.99 | 6.98 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 100.4 | 98.7 | ||||
| アトロピン 硫酸塩注 0.5mg 「タナベ」 |
ニプロ ES ファーマ |
0.5mg/mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.19 | - | - | 8.18 | 8.20 | 8.08 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 98.7 | ||||
| アトロピン 硫酸塩注 0.5mg 「タナベ」 |
ニプロ ES ファーマ |
0.5mg/mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.99 | - | - | 7.73 | 7.70 | 7.73 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 98.3 | ||||
| ブスコパン注 20mg |
サノフィ | 20mg/mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.02 | - | - | 8.13 | 8.13 | 7.99 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| ブスコパン注 20mg |
サノフィ | 20mg/mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.80 | - | - | 7.79 | 7.65 | 7.68 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.4 | 99.6 | ||||
| ラシックス注 20mg |
サノフィ | 20mg/2 mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.52 | - | - | 8.44 | 8.47 | 8.33 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| ラシックス注 20mg |
サノフィ | 20mg/2mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.03 | - | - | 7.75 | 7.82 | 7.76 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.4 | 99.6 | ||||
| ガスター注射液 20mg |
L T L ファーマ |
20mg/2mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.14 | - | - | 7.15 | 7.16 | 7.15 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| ガスター注射液 20mg |
L T L ファーマ |
20mg/2mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.08 | - | - | 7.10 | 7.09 | 7.08 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.4 | 99.1 | ||||
| タガメット注射液 200mg | 大 日 本住友製薬 | 200mg/2mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.23 | - | - | 6.22 | 6.22 | 6.29 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 99.6 | 99.1 | ||||
| タガメット注射液 200mg | 大 日 本住友製薬 | 200mg/2mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.26 | - | - | 6.25 | 6.24 | 6.32 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.4 | 100.0 | ||||
| アロキシ静注 0.75mg |
大鵬薬品工 業 | 0.75mg/5mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.29 | - | - | 6.30 | 6.29 | 6.30 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.0 | 100.0 | ||||
| アロキシ静注 0.75mg |
大鵬薬品工 業 | 0.75mg/5mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.22 | - | - | 6.20 | 6.23 | 6.20 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.2 | 99.2 | ||||
| アロキシ 点滴静注バッグ 0.75mg |
大鵬薬品工 業 | 0.75mg/50mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.18 | - | - | 6.18 | 6.18 | 6.20 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.2 | 99.6 | ||||
| カイトリル注 1mg |
太 陽 ファルマ |
1mg/mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.82 | - | - | 7.85 | 7.86 | 7.86 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 100.0 | ||||
| カイトリル注 1mg |
太 陽 ファルマ |
1mg/mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.61 | - | - | 7.61 | 7.58 | 7.53 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.0 | 100.0 | ||||
| カイトリル注 3mg |
太 陽 ファルマ |
3mg/3mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.41 | - | - | 7.44 | 7.41 | 7.42 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.0 | 100.4 | ||||
| カイトリル注 3mg |
太 陽 ファルマ |
3mg/3mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.30 | - | - | 7.36 | 7.32 | 7.28 | ||||
| 残存率(%) | 100.0 | - | - | 100.9 | 100.4 | 101.3 | ||||
| カイトリル 点滴静注バッグ 3mg/50mL |
太 陽 ファルマ |
3mg/50mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.40 | - | - | 7.39 | 7.38 | 7.36 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.4 | 100.4 | ||||
| カイトリル 点滴静注バッグ 3mg/100mL |
太 陽 ファルマ |
3mg/100mL | 性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.33 | - | - | 7.37 | 7.35 | 7.35 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 99.6 | ||||
| オンダンセトロン注射液 2mg 「F」 |
富士製薬工 業 | 2mg/mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.68 | - | - | 7.66 | 7.67 | 7.65 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 100.0 | ||||
| オンダンセトロン注射液 2mg 「F」 |
富士製薬工 業 | 2mg/mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.49 | - | - | 7.60 | 7.54 | 7.50 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 99.6 | 100.0 | ||||
| オンダンセトロン注射液 4mg 「F」 |
富士製薬工 業 | 4mg/2mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.42 | - | - | 7.44 | 7.42 | 7.42 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.0 | 100.4 | ||||
| オンダンセトロン注射液 4mg 「F」 |
富士製薬工 業 | 4mg/2mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.31 | - | - | 7.35 | 7.32 | 7.34 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.4 | 100.9 | ||||
| ナゼア注射液 0.3mg |
L T L ファーマ |
0.3mg/2mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.95 | - | - | 7.96 | 7.95 | 7.91 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.0 | ||||
| ナゼア注射液 0.3mg |
L T L ファーマ |
0.3mg/2mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.62 | - | - | 7.72 | 7.64 | 7.59 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 99.6 | ||||
| プリンペラン注射液 10mg | 日医工 | 10mg/2mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.42 | - | - | 7.37 | 7.34 | 7.36 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 98.3 | ||||
| プリンペラン注射液 10mg | 日医工 | 10mg/2mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.33 | - | - | 7.24 | 7.22 | 7.20 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.4 | 98.7 | ||||
| オルガドロン注射液 1.9mg | アスペンジャパン | 1.9mg/0.5mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.20 | - | - | 8.17 | 8.16 | 8.11 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 98.7 | ||||
| オルガドロン注射液 1.9mg | アスペンジャパン | 1.9mg/0.5mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.76 | - | - | 7.71 | 7.74 | 7.81 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 99.6 | 98.3 | ||||
| ヒドロコルチゾンコハク酸エステル Na 注射用 100mg 「武田テバ」 |
武田テバ薬 品 | 100mg +Sal. 2mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.68 | - | - | 7.63 | 7.69 | 7.54 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| ヒドロコルチゾンコハク酸エステル Na 注射用 100mg 「武田テバ」 |
武田テバ薬 品 | 100mg +Sal. 2mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.62 | - | - | 7.61 | 7.57 | 7.40 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 99.6 | 99.6 | ||||
| ソル・コーテフ注射用 100mg | ファイザー | 100mg +DW 2mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.97 | - | - | 7.88 | 7.82 | 7.61 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.0 | ||||
| ソル・コーテフ注射用 100mg | ファイザー | 100mg +DW 2mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.76 | - | - | 7.72 | 7.69 | 7.48 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| ソル・メドロール静注用 500mg | ファイザー | 500mg +DW 8mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.60 | - | - | 7.52 | 7.53 | 7.39 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| ソル・メドロール静注用 500mg × 4 |
ファイザー | 2000mg +DW 32mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.54 | - | - | 7.53 | 7.52 | 7.42 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| デカドロン注射液 3.3mg |
アスペンジャパン | 3.3mg/mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.70 | - | - | 7.68 | 7.76 | 7.72 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 99.6 | 99.6 | ||||
| デカドロン注射液 3.3mg × 5 |
アスペンジャパン | 16.5mg/5mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.01 | - | - | 7.98 | 7.96 | 7.95 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 99.1 | ||||
| デキサート注射液 3.3mg |
富士製薬工 業 | 3.3mg/mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.58 | - | - | 7.60 | 7.53 | 7.54 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.0 | 100.0 | ||||
| デキサート注射液 3.3mg × 5 |
富士製薬工 業 | 16.5mg/5mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.08 | - | - | 8.07 | 8.00 | 8.02 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.0 | ||||
| 水溶性 ハイドロコートン 注射液 100mg |
日医工 | 100mg/2mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.91 | - | - | 7.87 | 7.82 | 7.76 | ||||
| 残存率(%) | 100.0 | - | - | 101.3 | 100.9 | 100.0 | ||||
| 水溶性 ハイドロコートン 注射液 500mg |
日医工 | 500mg/10mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.99 | - | - | 7.96 | 7.94 | 7.86 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.9 | 100.4 | ||||
| 水溶性 プレドニン 10mg |
シオノギファーマ | 10mg +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.69 | - | - | 7.64 | 7.67 | 7.65 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.4 | 100.9 | ||||
| 水溶性 プレドニン 10mg |
シオノギファーマ | 10mg +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.53 | - | - | 7.51 | 7.58 | 7.48 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.4 | 100.9 | ||||
| リンデロン注 100mg(2%) |
シオノギファーマ | 100mg/5mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.04 | - | - | 8.13 | 8.02 | 8.13 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.0 | ||||
| リンデロン注 100mg(2%) |
シオノギファーマ | 100mg/5mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.70 | - | - | 7.52 | 7.33 | 7.80 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.0 | ||||
| アリナミン F 100 注 | 武田テバ薬 品 | 100mg/20mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.66 | - | - | 5.65 | 5.65 | 5.67 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 99.6 | 99.1 | ||||
| アリナミン F 100 注 | 武田テバ薬 品 | 100mg/20mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.65 | - | - | 5.64 | 5.65 | 5.67 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| パントシン注 10% |
アルフレッサフ ァ ー マ | 200mg/2mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.34 | - | - | 6.34 | 6.33 | 6.34 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 99.6 | 100.0 | ||||
| パントシン注 10% |
アルフレッサフ ァ ー マ | 200mg/2mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.31 | - | - | 6.31 | 6.32 | 6.32 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 99.1 | 100.4 | ||||
| ビスラーゼ注射液 10mg |
ト ー アエイヨー | 10mg/mL +Sal. 50mL |
性状 | 黄色澄明 | - | - | 黄色澄明 | 黄色澄明 | 黄色澄明 | |
| pH | 7.27 | - | - | 7.24 | 7.20 | 7.02 | ||||
| 残存率(%) | 100.0 | - | - | 96.9 | 91.3 | 79.0 | ||||
| ビスラーゼ注射液 10mg |
ト ー アエイヨー | 10mg/mL +Sal. 250mL |
性状 | 黄色澄明 | - | - | 黄色澄明 | 黄色澄明 | 黄色澄明 | |
| pH | 7.18 | - | - | 7.06 | 6.92 | 6.49 | ||||
| 残存率(%) | 100.0 | 94.8 | 87.9 | 87.1 | 76.0 | 48.1 | ||||
| フレスミン S 注射液 1000µg |
エイワイファーマ | 1000μg/mL +Sal. 50mL |
性状 | 淡赤色澄明 | - | - | 淡赤色澄明 | 淡赤色澄明 | 淡赤色澄明 | |
| pH | 8.05 | - | - | 8.05 | 8.01 | 7.99 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.0 | 99.6 | ||||
| フレスミン S 注射液 1000µg |
エイワイファーマ | 1000μg/mL +Sal. 250mL |
性状 | 微赤色澄明 | - | - | 微赤色澄明 | 微赤色澄明 | 微赤色澄明 | |
| pH | 7.63 | - | - | 7.74 | 7.73 | 7.56 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.1 | 99.6 | ||||
| メチコバール注射液 500µg | エーザイ | 500μg/mL +Sal. 50mL |
性状 | 淡赤色澄明 | - | - | 淡赤色澄明 | 淡赤色澄明 | 淡赤色澄明 | |
| pH | 8.20 | - | - | 8.24 | 8.27 | 8.18 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.0 | 99.6 | ||||
| メチコバール注射液 500µg | エーザイ | 500μg/mL +Sal. 250mL |
性状 | 微赤色澄明 | - | - | 微赤色澄明 | 微赤色澄明 | 微赤色澄明 | |
| pH | 7.76 | - | - | 7.82 | 7.90 | 7.65 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.1 | ||||
| ケイツーN 静注 10mg |
エーザイ | 10mg/2mL +Sal. 50mL |
性状 | 微黄色澄明 | - | - | 微黄色澄明 | 微黄色澄明 | 微黄色澄明 | |
| pH | 8.07 | - | - | 8.04 | 8.03 | 8.00 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.4 | 99.6 | ||||
| ケイツーN 静注 10mg |
エーザイ | 10mg/2mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | ごく僅かな微黄色澄明 | |
| pH | 7.82 | - | - | 7.78 | 7.76 | 7.74 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.0 | 99.6 | ||||
| KCL 注 10mEq キット 「テルモ」 |
テルモ | 0.7455g/10mL +Sal. 250mL |
性状 | 淡黄色澄明 | - | - | 淡黄色澄明 | 淡黄色澄明 | 淡黄色澄明 | |
| pH | 7.54 | - | - | 7.44 | 7.29 | 6.74 | ||||
| 残存率(%) | 100.0 | 96.1 | 90.1 | 89.0 | 81.4 | 59.7 | ||||
| KCL 注 20mEq キット 「テルモ」 |
テルモ | 1.491g/20mL +Sal. 50mL |
性状 | 黄色澄明 | - | - | 黄色澄明 | 黄色澄明 | 黄色澄明 | |
| pH | 7.55 | - | - | 7.32 | 7.24 | 6.86 | ||||
| 残存率(%) | 100.0 | 99.1 | 96.1 | 94.5 | 89.8 | 72.0 | ||||
| アイソボリン点滴静注用 25mg × 16 |
ファイザー | 400mg +Sal. 500mL +Sal. 50mL |
性状 | 無色澄明 | 析出物あり | - | – | – | – | |
| pH | 7.36 | - | – | – | – | |||||
| 残存率(%) | 100.0 | - | – | – | – | |||||
| アイソボリン点滴静注用 25mg × 16 |
ファイザー | 400mg +Sal .500mL +Sal. 250mL |
性状 | 無色澄明 | 析出物あり | - | – | – | – | |
| pH | 7.38 | - | – | – | – | |||||
| 残存率(%) | 100.0 | - | – | – | – | |||||
| アイソボリン点滴静注用 25mg × 16 |
ファイザー | 400mg +Sal. 50mL |
性状 | 析出物あり | - | - | – | – | – | |
| pH | - | - | – | – | – | |||||
| 残存率(%) | - | - | – | – | – | |||||
| アイソボリン点滴静注用 25mg × 16 |
ファイザー | 400mg +Sal. 250mL |
性状 | 析出物あり | - | - | – | – | – | |
| pH | - | - | – | – | – | |||||
| 残存率(%) | - | - | – | – | – | |||||
| タチオン注射用 200mg |
長生堂製薬 | 200mg +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.29 | - | - | 7.32 | 7.31 | 7.27 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.1 | ||||
| タチオン注射用 200mg |
長生堂製薬 | 200mg +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.27 | - | - | 7.28 | 7.29 | 7.23 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 99.6 | 99.1 | ||||
| メイロン静注 8.4% (20mL 管) |
大塚製薬工 場 | 1.68g/20mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.05 | - | - | 8.08 | 8.10 | 8.14 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.4 | 100.0 | ||||
| メイロン静注 8.4% (20mL 管)× 3.5 |
大塚製薬工 場 | 5.88g/70mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.92 | - | - | 7.98 | 8.04 | 8.11 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.1 | ||||
| メイロン静注 8.4% (250mL 袋) |
大塚製薬工 場 | 21g/250mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.04 | - | - | 8.05 | 8.13 | 8.17 | ||||
| 残存率(%) | 100.0 | - | - | 100.9 | 100.4 | 99.1 | ||||
| メイロン静注 8.4% (250mL 袋) | 大塚製薬工 場 | 21g/250mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.06 | - | - | 8.07 | 8.11 | 8.12 | ||||
| 残存率(%) | 100.0 | - | - | 100.8 | 100.4 | 99.2 | ||||
| 注射用 エンドキサン 500mg |
塩野義製薬 | 500mg +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.21 | - | - | 7.98 | 7.82 | 7.22 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.0 | 100.4 | ||||
| 注射用 エンドキサン 500mg |
塩野義製薬 | 500mg +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.86 | - | - | 7.76 | 7.55 | 7.14 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 100.0 | ||||
| ダカルバジン注用 100 |
協和キリン | 100mg +Sal. 100mL +Sal. 50mL |
性状 | 無色澄明 | 析出物あり | - | – | – | – | |
| pH | 4.25 | - | – | – | – | |||||
| 残存率(%) | 100.0 | - | – | – | – | |||||
| ダカルバジン注用 100 |
協和キリン | 100mL +Sal. 100mL +Sal. 250mL |
性状 | 無色澄明 | 析出物あり | - | – | – | – | |
| pH | 4.28 | - | – | – | – | |||||
| 残存率(%) | 100.0 | - | – | – | – | |||||
| 注射用 イホマイド 1g |
塩野義製薬 | 1g +Sal. 25mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.08 | - | - | 8.16 | 8.13 | 7.95 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| 注射用 イホマイド 1g |
塩野義製薬 | 1g +Sal. 25mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.66 | - | - | 7.70 | 7.54 | 7.60 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 100.0 | 99.1 | ||||
| アリムタ注射用 500mg |
日 本 イーライ リ リ ー |
500mg +Sal. 100mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.77 | - | - | 7.77 | 7.82 | 7.77 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 99.6 | ||||
| アリムタ注射用 500mg |
日 本 イーライ リ リ ー |
500mg +Sal. 100mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.42 | - | - | 7.46 | 7.51 | 7.43 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.9 | 97.4 | ||||
| ジェムザール注射用 1g | 日 本 イーライ リ リ ー |
1g +Sal. 100mL +Sal. 50mL |
性状 | 無色澄明 | 析出物あり | - | – | – | – | |
| pH | 3.42 | - | – | – | – | |||||
| 残存率(%) | 100.0 | - | – | – | – | |||||
| ジェムザール注射用 1g | 日 本 イーライ リ リ ー |
1g +Sal. 100mL +Sal. 250mL |
性状 | 無色澄明 | 析出物あり | - | – | – | – | |
| pH | 3.47 | - | – | – | – | |||||
| 残存率(%) | 100.0 | - | – | – | – | |||||
| 5-FU 注 250mg × 3 |
協和キリン | 750mg/15mL +Sal. 100mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.39 | - | - | 8.41 | 8.42 | 8.42 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.0 | 99.6 | ||||
| 5-FU 注 250mg × 3 |
協和キリン | 750mg/15mL +Sal. 100mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.40 | - | - | 8.41 | 8.42 | 8.42 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 99.1 | ||||
| 5-FU 注 250mg × 3 |
協和キリン | 750mg/15mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.41 | - | - | 8.42 | 8.42 | 8.45 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 99.1 | ||||
| 5-FU 注 250mg × 3 |
協和キリン | 750mg/15mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.42 | - | - | 8.41 | 8.42 | 8.43 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.0 | ||||
| 注射用 メソトレキセート 50mg |
ファイザー | 50mg +Sal. 20mL +Sal. 50mL |
性状 | 淡黄色澄明 | - | - | 淡黄色澄明 | 淡黄色澄明 | 淡黄色澄明 | |
| pH | 8.04 | - | - | 7.90 | 7.75 | 7.72 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 98.7 | ||||
| 注射用 メソトレキセート 50mg |
ファイザー | 50mg +Sal. 20mL +Sal. 250mL |
性状 | 淡黄色澄明 | - | - | 淡黄色澄明 | 淡黄色澄明 | 淡黄色澄明 | |
| pH | 7.83 | - | - | 7.67 | 7.61 | 7.46 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 98.7 | ||||
| 注射用 メソトレキセート 50mg |
ファイザー | 50mg +5D 20mL +Sal. 50mL |
性状 | 淡黄色澄明 | - | - | 淡黄色澄明 | 淡黄色澄明 | 淡黄色澄明 | |
| pH | 8.13 | - | - | 7.98 | 7.87 | 7.69 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 98.7 | ||||
| 注射用 メソトレキセート 50mg |
ファイザー | 50mg +5D 20mL +Sal. 250mL |
性状 | 淡黄色澄明 | - | - | 淡黄色澄明 | 淡黄色澄明 | 淡黄色澄明 | |
| pH | 7.71 | - | - | 7.72 | 7.50 | 7.44 | ||||
| 残存率(%) | 100.0 | - | - | 99.1 | 99.1 | 97.4 | ||||
| 注射用 メソトレキセート 50mg |
ファイザー | 50mg +Sal. 250mL +Sal. 50mL |
性状 | 淡黄色澄明 | - | - | 淡黄色澄明 | 淡黄色澄明 | 淡黄色澄明 | |
| pH | 7.69 | - | - | 7.60 | 7.60 | 7.46 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 100.0 | 100.4 | ||||
| 注射用 メソトレキセート 50mg |
ファイザー | 50mg +Sal. 250mL +Sal. 250mL |
性状 | 淡黄色澄明 | - | - | 淡黄色澄明 | 淡黄色澄明 | 淡黄色澄明 | |
| pH | 7.58 | - | - | 7.42 | 7.46 | 7.38 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 99.6 | 98.7 | ||||
| 注射用 メソトレキセート 50mg |
ファイザー | 50mg +5D 250mL +Sal. 50mL |
性状 | 淡黄色澄明 | - | - | 淡黄色澄明 | 淡黄色澄明 | 淡黄色澄明 | |
| pH | 7.78 | - | - | 7.82 | 7.68 | 7.70 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.1 | 99.1 | ||||
| 注射用 メソトレキセート 50mg |
ファイザー | 50mg +5D 250mL +Sal. 250mL |
性状 | 淡黄色澄明 | - | - | 淡黄色澄明 | 淡黄色澄明 | 淡黄色澄明 | |
| pH | 7.66 | - | - | 7.36 | 7.45 | 7.58 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 98.7 | ||||
| キロサイド注 100mg |
日本新薬 | 100mg/5mL +Sal. 20mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.33 | - | - | 8.07 | 7.99 | 7.81 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.0 | 100.4 | ||||
| キロサイド注 100mg |
日本新薬 | 100mg/5mL +Sal. 20mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.80 | - | - | 7.69 | 7.62 | 7.46 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 99.6 | 100.0 | ||||
| キロサイド注 100mg |
日本新薬 | 100mg/5mL +20D 20mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.09 | - | - | 7.92 | 7.85 | 7.76 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.4 | ||||
| キロサイド注 100mg |
日本新薬 | 100mg/5mL +20D 20mL +Sal.250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.75 | - | - | 7.65 | 7.57 | 7.49 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.0 | 100.9 | ||||
| キロサイド注 100mg |
日本新薬 | 100mg/5mL +Sal. 250mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.76 | - | - | 7.75 | 7.60 | 7.40 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 100.4 | ||||
| キロサイド注 100mg |
日本新薬 | 100mg/5mL +Sal. 250mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.57 | - | - | 7.52 | 7.46 | 7.30 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.9 | ||||
| キロサイド注 100mg |
日本新薬 | 100mg/5mL +5D 250mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.81 | - | - | 7.80 | 7.76 | 7.66 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 100.0 | 100.9 | ||||
| キロサイド注 100mg |
日本新薬 | 100mg/5mL +5D 250mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.48 | - | - | 7.44 | 7.50 | 7.32 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.4 | ||||
| アドリアシン注用 10 × 3 | アスペンジャパン | 30mg +Sal. 50mL |
性状 | だいだい赤色澄明 | - | - | だいだい赤色澄明 | だいだい赤色澄明 | だいだい赤色半透明 | |
| pH | 7.89 | - | - | 7.84 | 7.79 | 7.57 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.1 | ||||
| アドリアシン注用 10 × 3 | アスペンジャパン | 30mg +Sal. 250mL |
性状 | だいだい赤色澄明 | - | - | だいだい赤色澄明 | だいだい赤色澄明 | だいだい赤色澄明 | |
| pH | 7.67 | - | - | 7.53 | 7.59 | 7.45 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| アドリアシン注用 50 | アスペンジャパン | 50mg +Sal. 100mL +Sal. 50mL |
性状 | だいだい赤色澄明 | - | - | だいだい赤色澄明 | だいだい赤色澄明 | 析出物あり | |
| pH | 7.53 | - | - | 7.54 | 7.50 | |||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | |||||
| アドリアシン注用 50 | アスペンジャパン | 50mg +Sal. 100mL +Sal. 250mL |
性状 | だいだい赤色澄明 | - | - | だいだい赤色澄明 | だいだい赤色澄明 | 析出物あり | |
| pH | 7.38 | - | - | 7.38 | 7.28 | |||||
| 残存率(%) | 100.0 | - | - | 99.6 | 100.0 | |||||
| カルセド注射用 50mg |
大日本住友製 薬 | 50mg +Sal. 50mL +Sal. 50mL |
性状 | 析出物あり | - | - | – | – | – | |
| pH | - | - | – | – | – | |||||
| 残存率(%) | - | - | – | – | – | |||||
| カルセド注射用 50mg |
大日本住友製 薬 | 50mg +Sal. 50mL +Sal. 250mL |
性状 | 析出物あり | - | - | – | – | – | |
| pH | - | - | – | – | – | |||||
| 残存率(%) | - | - | – | – | – | |||||
| タキソール注射液 100mg × 3 |
ブリストル・マイヤーズ ス ク イ ブ |
300mg/50.1mL +Sal. 500mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.83 | - | - | 7.06 | 7.00 | 6.84 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| タキソール注射液 100mg × 3 |
ブリストル・マイヤーズ ス ク イ ブ |
300mg/50.1mL +Sal. 500mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.88 | - | - | 6.91 | 6.86 | 6.81 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| タキソール注射液 100mg × 3 |
ブリストル・マイヤーズ ス ク イ ブ |
300mg/50.1mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.45 | - | - | 7.49 | 7.52 | 7.48 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 100.0 | 99.6 | ||||
| タキソール注射液 100mg × 3 |
ブリストル・マイヤーズス ク イ ブ | 300mg/50.1mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.27 | - | - | 7.24 | 7.18 | 7.20 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.9 | 100.4 | ||||
| タキソテール点滴静注用 80mg × 1.4 | サノフィ | 112mg/2.8mL +13E 8.4mL +Sal. 500mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.94 | - | - | 5.87 | 5.85 | 5.62 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.0 | ||||
| タキソテール点滴静注用 80mg × 1.4 | サノフィ | 112mg/2.8mL +13E 8.4mL +Sal. 500mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.89 | - | - | 5.62 | 5.63 | 6.20 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 100.0 | 99.6 | ||||
| タキソテール点滴静注用 80mg × 1.4 | サノフィ | 112mg/2.8mL +13E 8.4mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.55 | - | - | 6.61 | 6.60 | 6.64 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 99.6 | ||||
| タキソテール点滴静注用 80mg × 1.4 | サノフィ | 112mg/2.8mL +13E 8.4mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.25 | - | - | 6.43 | 5.95 | 6.52 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 100.0 | 100.4 | ||||
| トポテシン点滴静注 40mg | 第一三共 | 40mg/2mL +Sal. 500mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.39 | - | - | 5.93 | 6.25 | 6.20 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.4 | 100.4 | ||||
| トポテシン点滴静注 40mg | 第一三共 | 40mg/2mL +Sal. 500mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.04 | - | - | 5.82 | 6.04 | 6.21 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.0 | 100.0 | ||||
| トポテシン点滴静注 40mg | 第一三共 | 40mg/2mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.96 | - | - | 6.97 | 6.70 | 6.84 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 100.0 | 99.6 | ||||
| トポテシン点滴静注 40mg | 第一三共 | 40mg/2mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.56 | - | - | 6.49 | 6.58 | 6.51 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 100.4 | 100.0 | ||||
| ファルモルビシン RTU 注射液 10mg* × 9 |
ファイザー | 90mg/45mL +Sal. 250mL +Sal. 50mL |
性状 | 析出物あり | - | - | – | – | – | |
| pH | - | - | – | – | – | |||||
| 残存率(%) | - | - | – | – | – | |||||
| ファルモルビシン RTU 注射液 10mg* × 9 |
ファイザー | 90mg/45mL +Sal. 250mL +Sal. 250mL |
性状 | 析出物あり | - | - | – | – | – | |
| pH | - | - | – | – | – | |||||
| 残存率(%) | - | - | – | – | – | |||||
| ファルモルビシン RTU 注射液 10mg* × 9 |
ファイザー | 90mg/45mL +5D 250mL +Sal. 50mL |
性状 | 析出物あり | - | - | – | – | – | |
| pH | - | - | – | – | – | |||||
| 残存率(%) | - | - | – | – | – | |||||
| ファルモルビシン RTU 注射液 10mg* × 9 |
ファイザー | 90mg/45mL +5D 250mL +Sal. 250mL |
性状 | 析出物あり | - | - | – | – | – | |
| pH | - | - | – | – | – | |||||
| 残存率(%) | - | - | – | – | – | |||||
| ファルモルビシン RTU 注射液 10mg* × 9 |
ファイザー | 90mg/45mL +Sal. 50mL |
性状 | 析出物あり | - | - | – | – | – | |
| pH | - | - | – | – | – | |||||
| 残存率(%) | - | - | – | – | – | |||||
| ファルモルビシン RTU 注射液 10mg* × 9 |
ファイザー | 90mg/45mL +Sal. 250mL |
性状 | 析出物あり | - | - | – | – | – | |
| pH | - | - | – | – | – | |||||
| 残存率(%) | - | - | – | – | – | |||||
| ピノルビン注射用 20mg | 日本マイクロバ イ オフ ァ ー マ | 20mg +Sal. 10mL +Sal. 50mL |
性状 | 薄い 赤橙色澄明 |
- | - | 薄い 赤橙色澄明 |
薄い 赤橙色澄明 |
薄い 赤橙色澄明 |
|
| pH | 7.88 | - | - | 7.61 | 7.44 | 7.24 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 100.0 | ||||
| ピノルビン注射用 20mg | 日本マイクロバ イ オフ ァ ー マ | 20mg +Sal. 10mL +Sal. 250mL |
性状 | 薄い 赤橙色澄明 |
- | - | 薄い 赤橙色澄明 |
薄い 赤橙色澄明 |
析出物あり | |
| pH | 7.66 | - | - | 7.44 | 7.40 | |||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | |||||
| ピノルビン注射用 20mg | 日本マイクロバ イ オフ ァ ー マ | 20mg +5D 10mL +Sal. 50mL |
性状 | 薄い 赤橙色澄明 |
- | - | 薄い 赤橙色澄明 |
薄い 赤橙色澄明 |
薄い 赤橙色澄明 |
|
| pH | 7.96 | - | - | 7.64 | 7.50 | 7.23 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 100.0 | ||||
| ピノルビン注射用 20mg | 日本マイクロバ イ オフ ァ ー マ | 20mg +5D 10mL +Sal. 250mL |
性状 | 薄い 赤橙色澄明 |
- | - | 薄い 赤橙色澄明 |
薄い 赤橙色澄明 |
析出物あり | |
| pH | 7.66 | - | - | 7.42 | 7.43 | |||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | |||||
| ドキシル注 20mg × 4 |
ヤンセンファーマ | 80mg/40mL +5D 250mL +Sal. 50mL |
性状 | 薄い赤色 | - | - | 薄い赤色 | 薄い赤色 | 薄い赤色 | |
| pH | 6.86 | - | - | 6.66 | 6.83 | 6.77 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.4 | ||||
| ドキシル注 20mg × 4 |
ヤンセンファーマ | 80mg/40mL +5D 250mL +Sal. 250mL |
性状 | 薄い赤色 | - | - | 薄い赤色 | 薄い赤色 | 薄い赤色 | |
| pH | 6.78 | - | - | 6.75 | 6.73 | 6.72 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.4 | 100.9 | ||||
| ナベルビン注 40 | 協和キリン | 40mg/4mL +Sal. 50mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.77 | - | - | 5.79 | 5.78 | 5.77 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 99.6 | 100.0 | ||||
| ナベルビン注 40 | 協和キリン | 40mg/4mL +Sal. 50mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.78 | - | - | 5.79 | 5.77 | 5.81 | ||||
| 残存率(%) | 100.0 | - | - | 100.9 | 100.9 | 100.9 | ||||
| ラステット注 100mg/5mL |
日本化薬 | 100mg/5mL +Sal. 500mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.70 | - | - | 5.74 | 5.72 | 5.77 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.4 | 100.4 | ||||
| ラステット注 100mg/5mL |
日本化薬 | 100mg/5mL +Sal. 500mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.72 | - | - | 5.76 | 5.73 | 5.74 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.0 | ||||
| ラステット注 100mg/5mL |
日本化薬 | 100mg/5mL +5D 500mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.78 | - | - | 5.78 | 5.79 | 5.79 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.4 | 100.0 | ||||
| ラステット注 100mg/5mL |
日本化薬 | 100mg/5mL +5D 500mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.76 | - | - | 5.74 | 5.75 | 5.73 | ||||
| 残存率(%) | 100.0 | - | - | 100.9 | 100.9 | 100.9 | ||||
| ラステット注 100mg/5mL |
日本化薬 | 100mg/5mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.96 | - | - | 5.95 | 5.93 | 5.94 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.0 | 100.0 | ||||
| ラステット注 100mg/5mL |
日本化薬 | 100mg/5mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.84 | - | - | 5.87 | 5.85 | 5.85 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.0 | 100.0 | ||||
| オンコビン注射用 1mg | 日本化薬 | 1mg +Sal. 10mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.03 | - | - | 7.95 | 8.03 | 7.97 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 100.0 | 100.0 | ||||
| オンコビン注射用 1mg | 日本化薬 | 1mg +Sal. 10mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.42 | - | - | 7.60 | 7.57 | 7.49 | ||||
| 残存率(%) | 100.0 | - | - | 99.2 | 99.6 | 99.2 | ||||
| オンコビン注射用 1mg | 日本化薬 | 1mg +5D 10mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 8.07 | - | - | 8.12 | 7.97 | 8.04 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.4 | 100.0 | ||||
| オンコビン注射用 1mg | 日本化薬 | 1mg +5D 10mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.72 | - | - | 7.71 | 7.69 | 7.66 | ||||
| 残存率(%) | 100.0 | - | - | 100.8 | 100.0 | 100.0 | ||||
| 注射用 フィルデシン 3mg |
日医工 | 3mg +Sal. 3mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.80 | - | - | 7.89 | 7.90 | 7.79 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.0 | ||||
| 注射用 フィルデシン 3mg |
日医工 | 3mg +Sal. 3mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.44 | - | - | 7.58 | 7.62 | 7.58 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 99.6 | ||||
| エクザール注射用 10mg | 日本化薬 | 10mg +Sal. 10mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.55 | - | - | 7.55 | 7.53 | 7.54 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 99.6 | 99.6 | ||||
| エクザール注射用 10mg | 日本化薬 | 10mg +Sal. 10mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.36 | - | - | 7.31 | 7.31 | 7.35 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| オニバイド点滴静注 43mg × 3 |
日 本 セルヴィエ |
129mg/30mL +Sal 500mL +Sal. 50mL |
性状 | 薄い白色 | - | - | 薄い白色 | 薄い白色 | 薄い白色 | |
| pH | 7.22 | - | - | 7.14 | 7.14 | 7.08 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.0 | ||||
| オニバイド点滴静注 43mg × 3 |
日 本 セルヴィエ |
129mg/30mL +Sal. 500mL +Sal. 250mL |
性状 | 薄い白色 | - | - | 薄い白色 | 薄い白色 | 薄い白色 | |
| pH | 7.21 | - | - | 7.17 | 7.14 | 7.06 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.0 | ||||
| オニバイド点滴静注 43mg × 3 |
日 本 セルヴィエ |
129 mg/30mL +5D 500mL +Sal. 50mL |
性状 | 薄い白色 | - | - | 薄い白色 | 薄い白色 | 薄い白色 | |
| pH | 7.28 | - | - | 7.25 | 7.28 | 7.15 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| オニバイド点滴静注 43mg × 3 |
日 本 セルヴィエ |
129mg/30mL +5D 500mL +Sal. 250mL |
性状 | 薄い白色 | - | - | 薄い白色 | 薄い白色 | 薄い白色 | |
| pH | 7.24 | - | - | 7.22 | 7.18 | 7.11 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.4 | 100.0 | ||||
| エルプラット点滴静注液 100mg |
ヤクルト本 社 | 100mg /20mL +5D 250mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.58 | - | - | 7.62 | 7.51 | 7.26 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 100.0 | 98.7 | ||||
| エルプラット点滴静注液 100mg |
ヤクルト本 社 | 100mg /20mL +5D 250mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.35 | - | - | 7.32 | 7.22 | 7.10 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.0 | ||||
| エルプラット点滴静注液 100mg |
ヤクルト本 社 | 100mg /20mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.96 | - | - | 7.86 | 7.74 | 7.69 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.0 | ||||
| エルプラット点滴静注液 100mg |
ヤクルト本 社 | 100mg /20mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.71 | - | - | 7.66 | 7.68 | 7.58 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 100.0 | ||||
| パラプラチン注射液 150mg × 4 |
ブリストル・マイヤーズ ス ク イ ブ |
600mg/60mL +Sal. 250mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.40 | - | - | 7.49 | 7.49 | 7.36 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.0 | 100.4 | ||||
| パラプラチン注射液 150mg × 4 |
ブリストル・ マイヤーズス ク イ ブ |
600mg/60mL +Sal. 250mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.26 | - | - | 7.36 | 7.36 | 7.20 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.0 | ||||
| パラプラチン注射液 150mg × 4 |
ブリストル・ マイヤーズス ク イ ブ |
600mg/60mL +5D 250mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.36 | - | - | 7.43 | 7.36 | 7.08 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.4 | 100.0 | ||||
| パラプラチン注射液 150mg × 4 |
ブリストル・ マイヤーズス ク イ ブ |
600mg/60mL +5D 250mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.33 | - | - | 7.32 | 7.25 | 7.06 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| パラプラチン注射液 150mg × 4 |
ブリストル・ マイヤーズス ク イ ブ |
600mg/60mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.80 | - | - | 7.70 | 7.69 | 7.57 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.0 | 100.4 | ||||
| パラプラチン注射液 150mg × 4 |
ブリストル・ マイヤーズス ク イ ブ |
600mg/60mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.43 | - | - | 7.56 | 7.60 | 7.41 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.9 | 100.4 | ||||
| ランダ注 50mg/100mL × 3 |
日本化薬 | 150mg/300mL +Sal. 600mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.96 | - | - | 6.09 | 6.05 | 6.22 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.0 | ||||
| ランダ注 50mg/100mL × 3 |
日本化薬 | 150mg/300mL +Sal. 600mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.98 | - | - | 6.05 | 6.02 | 6.19 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.4 | 100.4 | ||||
| ランダ注 50mg/100mL × 3 |
日本化薬 | 150mg/300mL +5D 600mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.87 | - | - | 5.84 | 5.85 | 5.98 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| ランダ注 50mg/100mL × 3 |
日本化薬 | 150mg/300mL +5D 600mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.87 | - | - | 5.87 | 5.88 | 6.03 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.0 | ||||
| ランダ注 50mg/100mL × 3 |
日本化薬 | 150mg/300mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.18 | - | - | 6.19 | 6.20 | 6.38 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 100.0 | 99.2 | ||||
| ランダ注 50mg/100mL × 3 |
日本化薬 | 150mg/300mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.13 | - | - | 6.14 | 6.14 | 6.32 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 100.0 | ||||
| アクプラ静注用 100mg × 2 |
日医工 | 200mg +Sal. 300mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.69 | - | - | 7.81 | 7.73 | 7.94 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.4 | 99.6 | ||||
| アクプラ静注用 100mg × 2 |
日医工 | 200mg +Sal. 300mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.38 | - | - | 7.60 | 7.64 | 7.77 | ||||
| 残存率(%) | 100.0 | - | - | 100.8 | 100.8 | 100.4 | ||||
| アクプラ静注用 100mg × 2 |
日医工 | 200mg +5X 300mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.72 | - | - | 7.96 | 7.80 | 7.87 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 99.6 | 99.1 | ||||
| アクプラ静注用 100mg × 2 |
日医工 | 200mg +5X 300mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.61 | - | - | 7.66 | 7.60 | 7.69 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.4 | 100.0 | ||||
| エンハーツ点滴静注用 100mg × 4 | 第一三共 | 400mg +DW 20mL +5D 250mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 6.02 | - | - | 6.03 | 5.96 | 6.02 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| エンハーツ点滴静注用 100mg × 4 | 第一三共 | 400mg +DW 20mL +5D 250mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 5.98 | - | - | 5.98 | 5.96 | 5.99 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 99.2 | ||||
| ネオレスタール注射液 10mg | 富士製薬工 業 | 10mg/mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.24 | - | - | 7.27 | 7.27 | 7.28 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.4 | 99.6 | ||||
| ネオレスタール注射液 10mg | 富士製薬工 業 | 10mg/mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.18 | - | - | 7.17 | 7.20 | 7.22 | ||||
| 残存率(%) | 100.0 | - | - | 99.6 | 99.6 | 99.2 | ||||
| ポララミン注 5mg |
高田製薬 | 5mg/mL +Sal. 50mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.45 | - | - | 7.58 | 7.60 | 7.58 | ||||
| 残存率(%) | 100.0 | - | - | 100.4 | 100.0 | 99.6 | ||||
| ポララミン注 5mg |
高田製薬 | 5mg/mL +Sal. 250mL |
性状 | 無色澄明 | - | - | 無色澄明 | 無色澄明 | 無色澄明 | |
| pH | 7.42 | - | - | 7.43 | 7.46 | 7.55 | ||||
| 残存率(%) | 100.0 | - | - | 100.0 | 100.0 | 99.6 | ||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg |
大鵬薬品工業 アスペンジャパン |
0.75mg/5mL +3.3mg/mL +Sal. 50mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.40 | 6.39 | 6.38 | 6.38 | ||||||
| 残存率(%) | 100.0 | 99.2 | 99.6 | 100.0 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg |
大鵬薬品工業 アスペンジャパン |
0.75mg/5mL +3.3mg/mL +Sal. 250mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.38 | 6.34 | 6.34 | 6.34 | ||||||
| 残存率(%) | 100.0 | 99.6 | 99.2 | 100.0 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 1、1.65mg × 1 |
大鵬薬品工業 | 0.75mg/5mL | 性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.45 | 6.43 | 6.43 | 6.42 | ||||||
| アスペンジャパン | +4.95mg/1.5mL +Sal. 50mL |
|||||||||
| 残存率(%) | 100.0 | 99.6 | 99.6 | 99.6 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 1、1.65mg × 1 |
大鵬薬品工業 | 0.75mg/5mL | 性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.40 | 6.39 | 6.38 | 6.38 | ||||||
| アスペンジャパン | +4.95mg/1.5mL +Sal. 250mL |
|||||||||
| 残存率(%) | 100.0 | 100.0 | 99.6 | 100.0 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3 |
大鵬薬品工業 アスペンジャパン |
0.75mg/5mL +9.9mg/3mL +Sal. 50mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.60 | 6.57 | 6.55 | 6.54 | ||||||
| 残存率(%) | 100.0 | 100.0 | 100.0 | 100.0 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3 |
大鵬薬品工業 アスペンジャパン |
0.75mg/5mL +9.9mg/3mL +Sal. 250mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.56 | 6.52 | 6.50 | 6.50 | ||||||
| 残存率(%) | 100.0 | 100.8 | 100.4 | 100.4 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 5 |
大鵬薬品工業 アスペンジャパン |
0.75mg/5mL +16.5mg/5mL +Sal. 50mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.73 | 6.70 | 6.68 | 6.66 | ||||||
| 残存率(%) | 100.0 | 100.0 | 100.0 | 100.0 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 5 |
大鵬薬品工業 アスペンジャパン |
0.75mg/5mL +16.5mg/5mL +Sal. 250mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.65 | 6.62 | 6.61 | 6.60 | ||||||
| 残存率(%) | 100.0 | 99.6 | 99.6 | 100.0 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg |
大鵬薬品工業 | 0.75mg/50mL | 性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.31 | 6.29 | 6.28 | 6.28 | ||||||
| アスペンジャパン | +3.3mg/mL | |||||||||
| 残存率(%) | 100.0 | 99.6 | 100.0 | 99.1 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 1、1.65mg × 1 |
大鵬薬品工業アスペンジャパン | 0.75mg/50mL +4.95mg/1.5mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.34 | 6.33 | 6.33 | 6.34 | ||||||
| 残存率(%) | 100.0 | 100.0 | 100.0 | 99.6 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3 |
大鵬薬品工業 | 0.75mg/50mL | 性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.52 | 6.47 | 6.46 | 6.46 | ||||||
| アスペンジャパン | +9.9mg/3mL | |||||||||
| 残存率(%) | 100.0 | 100.0 | 99.6 | 99.1 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 5 |
大鵬薬品工業 | 0.75mg/50mL | 性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.65 | 6.60 | 6.57 | 6.58 | ||||||
| アスペンジャパン | +16.5mg/5mL | |||||||||
| 残存率(%) | 100.0 | 100.0 | 100.4 | 100.0 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg |
太陽ファルマ アスペンジャパン |
1mg/mL +3.3mg/mL +Sal. 50mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.84 | 7.83 | 7.83 | 7.85 | ||||||
| 残存率(%) | 100.0 | 99.6 | 100.0 | 100.0 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg |
太陽ファルマ アスペンジャパン |
1mg/mL +3.3mg/mL +Sal. 250mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.59 | 7.65 | 7.69 | 7.59 | ||||||
| 残存率(%) | 100.0 | 100.4 | 99.6 | 100.4 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 5 |
太陽ファルマ アスペンジャパン |
1mg/mL +16.5mg/5mL +Sal. 50mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.90 | 7.89 | 7.88 | 7.84 | ||||||
| 残存率(%) | 100.0 | 100.0 | 100.0 | 99.1 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 5 |
太陽ファルマ アスペンジャパン |
1mg/mL +16.5mg/5mL +Sal. 250mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.73 | 7.77 | 7.74 | 7.69 | ||||||
| 残存率(%) | 100.0 | 100.0 | 98.7 | 99.1 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg |
太陽ファルマ アスペンジャパン |
3mg/3mL +3.3mg/mL +Sal. 50mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.50 | 7.49 | 7.48 | 7.50 | ||||||
| 残存率(%) | 100.0 | 100.0 | 100.0 | 100.5 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg |
太陽ファルマ アスペンジャパン |
3mg/3mL +3.3mg/mL +Sal. 250mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.26 | 7.40 | 7.37 | 7.36 | ||||||
| 残存率(%) | 100.0 | 100.0 | 100.0 | 99.6 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 5 |
太陽ファルマ アスペンジャパン |
3mg/3mL +16.5mg/5mL +Sal. 50mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.66 | 7.61 | 7.59 | 7.59 | ||||||
| 残存率(%) | 100.0 | 99.6 | 99.6 | 100.4 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 5 |
太陽ファルマ アスペンジャパン |
3mg/3mL +16.5mg/5mL +Sal. 250mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.47 | 7.52 | 7.63 | 7.50 | ||||||
| 残存率(%) | 100.0 | 99.6 | 101.8 | 100.0 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3 ネオレスタール注射液 10mg |
大鵬薬品工業アスペンジャパン 富士製薬工業 |
0.75mg/5mL +9.9mg/3mL +10mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.40 | 6.41 | 6.41 | 6.39 | ||||||
| 残存率(%) | - | 100.0 | 100.4 | 100.8 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3 ネオレスタール注射液 10mg |
大鵬薬品工業アスペンジャパン 富士製薬工業 |
0.75mg/50mL +9.9mg/3mL +10mg/mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.32 | 6.35 | 6.34 | 6.35 | ||||||
| 残存率(%) | - | 100.4 | 100.4 | 100.4 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3 ネオレスタール注射液 10mg |
太陽ファルマアスペンジャパン 富士製薬工業 |
1mg/mL +9.9mg/3mL +10mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.26 | 7.23 | 7.22 | 7.22 | ||||||
| 残存率(%) | - | 100.4 | 100.4 | 100.4 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3 ネオレスタール注射液 10mg |
太陽ファルマアスペンジャパン 富士製薬工業 |
3mg/3mL +9.9mg/3mL +10mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.09 | 7.07 | 7.02 | 7.06 | ||||||
| 残存率(%) | - | 100.0 | 99.6 | 98.7 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg |
大鵬薬品工業アスペンジャパン 高田製薬 |
0.75mg/5mL +9.9mg/3mL +5mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.42 | 6.46 | 6.45 | 6.44 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 100.0 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg |
大鵬薬品工業アスペンジャパン 高田製薬 |
0.75mg/50mL +9.9mg/3mL +5mg/mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.40 | 6.41 | 6.40 | 6.40 | ||||||
| 残存率(%) | - | 100.4 | 100.4 | 100.8 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg |
太陽ファルマアスペンジャパン 高田製薬 |
1mg/mL +9.9mg/3mL +5mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.49 | 7.47 | 7.46 | 7.42 | ||||||
| 残存率(%) | - | 100.0 | 99.6 | 99.6 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg |
太陽ファルマアスペンジャパン 高田製薬 |
3mg/3mL +9.9mg/3mL +5mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.31 | 7.28 | 7.28 | 7.23 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 99.6 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3 アタラックス-P 注射液(50mg/mL) |
大鵬薬品工業アスペンジャパン ファイザー |
0.75mg/5mL +9.9mg/3mL +50mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.37 | 6.40 | 6.41 | 6.41 | ||||||
| 残存率(%) | - | 99.6 | 99.6 | 99.6 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3 アタラックス-P 注射液(50mg/mL) |
大鵬薬品工業アスペンジャパン ファイザー |
0.75mg/50mL +9.9mg/3mL +50mg/mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.33 | 6.36 | 6.36 | 6.36 | ||||||
| 残存率(%) | - | 100.0 | 100.4 | 100.0 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3 アタラックス-P 注射液(50mg/mL) |
太陽ファルマアスペンジャパン ファイザー |
1mg/mL +9.9mg/3mL +50mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.06 | 7.05 | 7.05 | 7.02 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 99.6 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3 アタラックス-P 注射液(50mg/mL) |
太陽ファルマアスペンジャパン ファイザー |
3mg/3mL +9.9mg/3mL +50mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.95 | 6.95 | 6.95 | 6.92 | ||||||
| 残存率(%) | - | 99.6 | 100.0 | 99.1 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3 ガスター注射液 20mg |
大鵬薬品工業アスペンジャパン LTL ファーマ |
0.75mg/5mL +9.9mg/3mL +20mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.46 | 6.49 | 6.49 | 6.48 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 100.4 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3 ガスター注射液 20mg |
大鵬薬品工業アスペンジャパン LTL ファーマ |
0.75mg/50mL +9.9mg/3mL +20mg/2mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.40 | 6.44 | 6.44 | 6.44 | ||||||
| 残存率(%) | - | 100.0 | 100.4 | 100.4 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3 ガスター注射液 20mg |
太陽ファルマアスペンジャパン LTL ファーマ |
1mg/mL +9.9mg/3mL +20mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.17 | 7.17 | 7.18 | 7.15 | ||||||
| 残存率(%) | - | 100.4 | 100.4 | 99.6 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3 ガスター注射液 20mg |
太陽ファルマアスペンジャパン LTL ファーマ |
3mg/3mL +9.9mg/3mL +20mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.08 | 7.07 | 7.07 | 7.05 | ||||||
| 残存率(%) | - | 100.4 | 100.4 | 99.6 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3 タガメット注射液 200mg |
大鵬薬品工業アスペンジャパン大日本住友製薬 | 0.75mg/5mL +9.9mg/3mL +200mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.18 | 6.21 | 6.19 | 6.21 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 100.8 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3 タガメット注射液 200mg |
大鵬薬品工業アスペンジャパン大日本住友製薬 | 0.75mg/50mL +9.9mg/3mL +200mg/2mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.16 | 6.17 | 6.17 | 6.19 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 100.4 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3 タガメット注射液 200mg |
太陽ファルマアスペンジャパン大日本住友製薬 | 1mg/mL +9.9mg/3mL +200mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.41 | 6.42 | 6.42 | 6.41 | ||||||
| 残存率(%) | - | 100.4 | 100.0 | 99.6 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3 タガメット注射液 200mg |
太陽ファルマアスペンジャパン大日本住友製薬 | 3mg/3mL +9.9mg/3mL +200mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.39 | 6.39 | 6.40 | 6.39 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 100.0 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3 ラシックス注 20mg |
大鵬薬品工業アスペンジャパン サノフィ |
0.75mg/5mL +9.9mg/3mL +20mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.57 | 6.55 | 6.57 | 6.60 | ||||||
| 残存率(%) | - | 100.4 | 100.4 | 100.4 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3 ラシックス注 20mg |
大鵬薬品工業アスペンジャパン サノフィ |
0.75mg/50mL +9.9mg/3mL +20mg/2mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.51 | 6.51 | 6.51 | 6.53 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 100.0 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3 ラシックス注 20mg |
太陽ファルマアスペンジャパン サノフィ |
1mg/mL +9.9mg/3mL +20mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.78 | 7.79 | 7.80 | 7.79 | ||||||
| 残存率(%) | - | 100.0 | 100.4 | 99.6 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3 ラシックス注 20mg |
太陽ファルマアスペンジャパン サノフィ |
3mg/3mL +9.9mg/3mL +20mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.56 | 7.56 | 7.58 | 7.55 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 99.6 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3 プリンペラン注射液 10mg |
大鵬薬品工業アスペンジャパン 日医工 |
0.75mg/5mL +9.9mg/3mL +10mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.50 | 6.49 | 6.49 | 6.42 | ||||||
| 残存率(%) | - | 100.4 | 100.4 | 100.4 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3 プリンペラン注射液 10mg |
大鵬薬品工業アスペンジャパン 日医工 |
0.75mg/50mL +9.9mg/3mL +10mg/2mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.46 | 6.46 | 6.46 | 6.39 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 100.0 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3 プリンペラン注射液 10mg |
太陽ファルマアスペンジャパン 日医工 |
1mg/mL +9.9mg/3mL +10mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.39 | 7.30 | 7.30 | 7.28 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 99.6 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3 プリンペラン注射液 10mg |
太陽ファルマアスペンジャパン 日医工 |
3mg/3mL +9.9mg/3mL +10mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.19 | 7.10 | 7.11 | 7.09 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 99.6 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3 ブスコパン注 20mg |
大鵬薬品工業アスペンジャパン サノフィ |
0.75mg/5mL +9.9mg/3mL +20mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.57 | 6.56 | 6.56 | 6.53 | ||||||
| 残存率(%) | - | 100.4 | 100.0 | 100.4 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3 ブスコパン注 20mg |
大鵬薬品工業アスペンジャパン サノフィ |
0.75mg/50mL +9.9mg/3mL +20mg/mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.47 | 6.50 | 6.50 | 6.46 | ||||||
| 残存率(%) | - | 100.9 | 100.4 | 100.9 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3 ブスコパン注 20mg |
太陽ファルマアスペンジャパン サノフィ |
1mg/mL +9.9mg/3mL +20mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.72 | 7.70 | 7.68 | 7.60 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 99.6 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3 ブスコパン注 20mg |
太陽ファルマアスペンジャパン サノフィ |
3mg/3mL +9.9mg/3mL +20mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.48 | 7.45 | 7.45 | 7.43 | ||||||
| 残存率(%) | - | 99.6 | 100.0 | 99.1 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3ネオレスタール注射液 10mgプリンペラン注射液 10mg |
大鵬薬品工業アスペンジャパン 富士製薬工業日医工 |
0.75mg/5mL +9.9mg/3mL +10mg/mL +10mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.38 | 6.38 | 6.37 | 6.32 | ||||||
| 残存率(%) | - | 99.6 | 99.6 | 99.6 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3ネオレスタール注射液 10mgプリンペラン注射液 10mg |
大鵬薬品工業アスペンジャパン 富士製薬工業日医工 |
0.75mg/50mL +9.9mg/3mL +10mg/mL +10mg/2mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.33 | 6.33 | 6.33 | 6.30 | ||||||
| 残存率(%) | - | 100.8 | 100.8 | 100.8 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3ネオレスタール注射液 10mgプリンペラン注射液 10mg |
太陽ファルマアスペンジャパン 富士製薬工業日医工 |
1mg/mL +9.9mg/3mL +10mg/mL +10mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.03 | 7.00 | 6.98 | 6.94 | ||||||
| 残存率(%) | - | 99.6 | 100.0 | 99.6 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3ネオレスタール注射液 10mgプリンペラン注射液 10mg |
太陽ファルマアスペンジャパン 富士製薬工業日医工 |
3mg/3mL +9.9mg/3mL +10mg/mL +10mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.93 | 6.89 | 6.86 | 6.82 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 100.0 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3ネオレスタール注射液 10mgブスコパン注 20mg |
大鵬薬品工業アスペンジャパン 富士製薬工業サノフィ |
0.75mg/5mL +9.9mg/3mL +10mg/mL +20mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.42 | 6.42 | 6.41 | 6.39 | ||||||
| 残存率(%) | - | 99.6 | 99.6 | 99.6 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3ネオレスタール注射液 10mgブスコパン注 20mg |
大鵬薬品工業アスペンジャパン 富士製薬工業サノフィ |
0.75mg/50mL +9.9mg/3mL +10mg/mL +20mg/mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.35 | 6.36 | 6.36 | 6.34 | ||||||
| 残存率(%) | - | 100.4 | 100.0 | 100.4 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3ネオレスタール注射液 10mgブスコパン注 20mg |
太陽ファルマアスペンジャパン 富士製薬工業サノフィ |
1mg/mL +9.9mg/3mL +10mg/mL +20mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.26 | 7.22 | 7.20 | 7.22 | ||||||
| 残存率(%) | - | 100.0 | 100.4 | 99.6 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3ネオレスタール注射液 10mgブスコパン注 20mg |
太陽ファルマアスペンジャパン 富士製薬工業サノフィ |
3mg/3mL +9.9mg/3mL +10mg/mL +20mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.07 | 7.03 | 7.04 | 7.04 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 99.6 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3ネオレスタール注射液 10mgガスター注射液 20mg |
大鵬薬品工業アスペンジャパン 富士製薬工業 LTL ファーマ |
0.75mg/5mL +9.9mg/3mL +10mg/mL +20mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.36 | 6.37 | 6.37 | 6.36 | ||||||
| 残存率(%) | - | 100.4 | 100.4 | 100.8 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3ネオレスタール注射液 10mgガスター注射液 20mg |
大鵬薬品工業アスペンジャパン 富士製薬工業 LTL ファーマ |
0.75mg/50mL +9.9mg/3mL +10mg/mL +20mg/2mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.32 | 6.32 | 6.33 | 6.32 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 100.4 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3ネオレスタール注射液 10mgガスター注射液 20mg |
太陽ファルマアスペンジャパン 富士製薬工業 LTL ファーマ |
1mg/mL +9.9mg/3mL +10mg/mL +20mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.91 | 6.92 | 6.93 | 6.92 | ||||||
| 残存率(%) | - | 100.0 | 100.4 | 100.0 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3ネオレスタール注射液 10mgガスター注射液 20mg |
太陽ファルマアスペンジャパン 富士製薬工業 LTL ファーマ |
3mg/3mL +9.9mg/3mL +10mg/mL +20mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.83 | 6.84 | 6.84 | 6.85 | ||||||
| 残存率(%) | - | 100.4 | 100.4 | 100.0 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3ネオレスタール注射液 10mgタガメット注射液 200mg |
大鵬薬品工業アスペンジャパン 富士製薬工業大日本住友製薬 |
0.75mg/5mL +9.9mg/3mL +10mg/mL +200mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.15 | 6.16 | 6.16 | 6.15 | ||||||
| 残存率(%) | - | 100.8 | 100.4 | 100.4 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3ネオレスタール注射液 10mgタガメット注射液 200mg |
大鵬薬品工業アスペンジャパン 富士製薬工業大日本住友製薬 |
0.75mg/50mL +9.9mg/3mL +10mg/mL +200mg/2mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.13 | 6.13 | 6.14 | 6.13 | ||||||
| 残存率(%) | - | 100.4 | 100.4 | 100.4 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3ネオレスタール注射液 10mgタガメット注射液 200mg |
太陽ファルマアスペンジャパン 富士製薬工業大日本住友製薬 |
1mg/mL +9.9mg/3mL +10mg/mL +200mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.37 | 6.37 | 6.36 | 6.36 | ||||||
| 残存率(%) | - | 99.6 | 99.6 | 100.0 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3ネオレスタール注射液 10mgタガメット注射液 200mg |
太陽ファルマアスペンジャパン 富士製薬工業大日本住友製薬 |
3mg/3mL +9.9mg/3mL +10mg/mL +200mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.33 | 6.33 | 6.33 | 6.32 | ||||||
| 残存率(%) | - | 99.6 | 99.6 | 100.0 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg プリンペラン注射液 10mg |
大鵬薬品工業アスペンジャパン 高田製薬日医工 |
0.75mg/5mL +9.9mg/3mL +5mg/mL +10mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.41 | 6.41 | 6.39 | 6.35 | ||||||
| 残存率(%) | - | 100.4 | 100.0 | 100.0 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg プリンペラン注射液 10mg |
大鵬薬品工業アスペンジャパン 高田製薬日医工 |
0.75mg/50mL +9.9mg/3mL +5mg/mL +10mg/2mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.36 | 6.35 | 6.35 | 6.32 | ||||||
| 残存率(%) | - | 99.6 | 100.4 | 100.0 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg プリンペラン注射液 10mg |
太陽ファルマアスペンジャパン 高田製薬日医工 |
1mg/mL +9.9mg/3mL +5mg/mL +10mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.17 | 7.07 | 7.07 | 7.06 | ||||||
| 残存率(%) | - | 100.0 | 98.7 | 100.0 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg プリンペラン注射液 10mg |
太陽ファルマアスペンジャパン 高田製薬日医工 |
3mg/3mL +9.9mg/3mL +5mg/mL +10mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.02 | 6.95 | 6.93 | 6.91 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 100.0 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg ブスコパン注 20mg |
大鵬薬品工業アスペンジャパン 高田製薬サノフィ |
0.75mg/5mL +9.9mg/3mL +5mg/mL +20mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.47 | 6.44 | 6.44 | 6.44 | ||||||
| 残存率(%) | - | 99.6 | 100.0 | 100.0 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg ブスコパン注 20mg |
大鵬薬品工業アスペンジャパン 高田製薬サノフィ |
0.75mg/50mL +9.9mg/3mL +5mg/mL +20mg/mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.40 | 6.39 | 6.39 | 6.39 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 99.6 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg ブスコパン注 20mg |
太陽ファルマアスペンジャパン 高田製薬サノフィ |
1mg/mL +9.9mg/3mL +5mg/mL +20mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.48 | 7.44 | 7.42 | 7.41 | ||||||
| 残存率(%) | - | 100.0 | 99.6 | 99.6 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg ブスコパン注 20mg |
太陽ファルマアスペンジャパン 高田製薬サノフィ |
3mg/3mL +9.9mg/3mL +5mg/mL +20mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.24 | 7.21 | 7.19 | 7.20 | ||||||
| 残存率(%) | - | 100.0 | 100.4 | 100.0 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3g ポララミン注 5mg ガスター注射液 20mg |
大鵬薬品工業アスペンジャパン 高田製薬 LTL ファーマ |
0.75mg/5mL +9.9mg/3mL +5mg/mL +20mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.41 | 6.42 | 6.42 | 6.41 | ||||||
| 残存率(%) | - | 100.4 | 100.0 | 99.6 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg ガスター注射液 20mg |
大鵬薬品工業アスペンジャパン 高田製薬 LTL ファーマ |
0.75mg/50mL +9.9mg/3mL +5mg/mL +20mg/2mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.36 | 6.33 | 6.35 | 6.37 | ||||||
| 残存率(%) | - | 100.4 | 100.0 | 99.6 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg ガスター注射液 20mg |
太陽ファルマアスペンジャパン 高田製薬 LTL ファーマ |
1mg/mL +9.9mg/3mL +5mg/mL +20mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.02 | 7.02 | 7.00 | 7.02 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 100.0 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg ガスター注射液 20mg |
太陽ファルマアスペンジャパン 高田製薬 LTL ファーマ |
3mg/3mL +9.9mg/3mL +5mg/mL +20mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.93 | 6.92 | 6.94 | 6.93 | ||||||
| 残存率(%) | - | 100.4 | 100.0 | 100.4 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg タガメット注射液 200mg |
大鵬薬品工業アスペンジャパン 高田製薬 大日本住友製薬 |
0.75mg/5mL +9.9mg/3mL +5mg/mL +200mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.18 | 6.18 | 6.18 | 6.18 | ||||||
| 残存率(%) | - | 100.8 | 100.4 | 100.0 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg タガメット注射液 200mg |
大鵬薬品工業アスペンジャパン 高田製薬 大日本住友製薬 |
0.75mg/50mL +9.9mg/3mL +5mg/mL +200mg/2mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.13 | 6.14 | 6.14 | 6.14 | ||||||
| 残存率(%) | - | 100.9 | 100.4 | 100.4 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg タガメット注射液 200mg |
太陽ファルマアスペンジャパン 高田製薬 大日本住友製薬 |
1mg/mL +9.9mg/3mL +5mg/mL +200mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.40 | 6.38 | 6.37 | 6.39 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 99.6 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3 ポララミン注 5mg タガメット注射液 200mg |
太陽ファルマアスペンジャパン 高田製薬 大日本住友製薬 |
3mg/3mL +9.9mg/3mL +5mg/mL +200mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.36 | 6.35 | 6.34 | 6.35 | ||||||
| 残存率(%) | - | 100.0 | 100.4 | 100.4 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3プリンペラン注射液 10mg ブスコパン注 20mg |
大鵬薬品工業アスペンジャパン 日医工サノフィ |
0.75mg/5mL +9.9mg/3mL +10mg/2mL +20mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.48 | 6.46 | 6.45 | 6.41 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 100.0 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3プリンペラン注射液 10mg ブスコパン注 20mg |
大鵬薬品工業アスペンジャパン 日医工サノフィ |
0.75mg/50mL +9.9mg/3mL +10mg/2mL +20mg/mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.40 | 6.40 | 6.39 | 6.36 | ||||||
| 残存率(%) | - | 100.0 | 100.4 | 100.4 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3プリンペラン注射液 10mg ブスコパン注 20mg |
太陽ファルマアスペンジャパン 日医工サノフィ |
1mg/mL +9.9mg/3mL +10mg/2mL +20mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.36 | 7.27 | 7.26 | 7.25 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 100.0 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3プリンペラン注射液 10mg ブスコパン注 20mg |
太陽ファルマアスペンジャパン 日医工サノフィ |
3mg/3mL +9.9mg/3mL +10mg/2mL +20mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.20 | 7.10 | 7.07 | 7.07 | ||||||
| 残存率(%) | - | 99.6 | 100.0 | 99.6 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3プリンペラン注射液 10mg ガスター注射液 20mg |
大鵬薬品工業アスペンジャパン 日医工 LTL ファーマ |
0.75mg/5mL +9.9mg/3mL +10mg/2mL +20mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.42 | 6.43 | 6.43 | 6.43 | ||||||
| 残存率(%) | - | 100.8 | 101.2 | 100.8 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3プリンペラン注射液 10mg ガスター注射液 20mg |
大鵬薬品工業アスペンジャパン 日医工 LTL ファーマ |
0.75mg/50mL +9.9mg/3mL +10mg/2mL +20mg/2mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.38 | 6.38 | 6.38 | 6.38 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 100.4 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3プリンペラン注射液 10mg ガスター注射液 20mg |
太陽ファルマアスペンジャパン 日医工 LTL ファーマ |
1mg/mL +9.9mg/3mL +10mg/2mL +20mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.02 | 7.01 | 7.02 | 7.02 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 100.0 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3プリンペラン注射液 10mg ガスター注射液 20mg |
太陽ファルマアスペンジャパン 日医工 LTL ファーマ |
3mg/3mL +9.9mg/3mL +10mg/2mL +20mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.93 | 6.94 | 6.94 | 6.94 | ||||||
| 残存率(%) | - | 100.4 | 100.4 | 100.4 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3プリンペラン注射液 10mg タガメット注射液 200mg |
大鵬薬品工業アスペンジャパン 日医工 大日本住友製薬 |
0.75mg/5mL +9.9mg/3mL +10mg/2mL +200mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.19 | 6.19 | 6.18 | 6.19 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 99.6 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3プリンペラン注射液 10mg タガメット注射液 200mg |
大鵬薬品工業アスペンジャパン 日医工 大日本住友製薬 |
0.75mg/50mL +9.9mg/3mL +10mg/2mL +200mg/2mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.16 | 6.15 | 6.15 | 6.16 | ||||||
| 残存率(%) | - | 100.4 | 100.4 | 100.4 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3プリンペラン注射液 10mg タガメット注射液 200mg |
太陽ファルマアスペンジャパン 日医工 大日本住友製薬 |
1mg/mL +9.9mg/3mL +10mg/2mL +200mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.40 | 6.39 | 6.41 | 6.40 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 99.6 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3プリンペラン注射液 10mg タガメット注射液 200mg |
太陽ファルマアスペンジャパン 日医工 大日本住友製薬 |
3mg/3mL +9.9mg/3mL +10mg/2mL +200mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.37 | 6.37 | 6.38 | 6.37 | ||||||
| 残存率(%) | - | 100.9 | 100.4 | 99.6 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3 ブスコパン注 20mg ガスター注射液 20mg |
大鵬薬品工業アスペンジャパン サノフィ LTL ファーマ |
0.75mg/5mL +9.9mg/3mL +20mg/mL +20mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.47 | 6.47 | 6.47 | 6.48 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 100.4 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3 ブスコパン注 20mg ガスター注射液 20mg |
大鵬薬品工業アスペンジャパン サノフィ LTL ファーマ |
0.75mg/50mL +9.9mg/3mL +20mg/mL +20mg/2mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.40 | 6.41 | 6.41 | 6.42 | ||||||
| 残存率(%) | - | 100.0 | 100.4 | 100.4 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3 ブスコパン注 20mg ガスター注射液 20mg |
太陽ファルマアスペンジャパン サノフィ LTL ファーマ |
1mg/mL +9.9mg/3mL +20mg/mL +20mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.15 | 7.17 | 7.16 | 7.16 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 99.6 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3 ブスコパン注 20mg ガスター注射液 20mg |
太陽ファルマアスペンジャパン サノフィ LTL ファーマ |
3mg/3mL +9.9mg/3mL +20mg/mL +20mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.05 | 7.06 | 7.05 | 7.06 | ||||||
| 残存率(%) | - | 100.0 | 99.6 | 99.1 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3 ブスコパン注 20mg タガメット注射液 200mg |
大鵬薬品工業アスペンジャパン サノフィ 大日本住友製薬 |
0.75mg/5mL +9.9mg/3mL +20mg/mL +200mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.20 | 6.20 | 6.20 | 6.20 | ||||||
| 残存率(%) | - | 100.4 | 100.4 | 100.4 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3 ブスコパン注 20mg タガメット注射液 200mg |
大鵬薬品工業アスペンジャパン サノフィ 大日本住友製薬 |
0.75mg/50mL +9.9mg/3mL +20mg/mL +200mg/2mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.17 | 6.17 | 6.17 | 6.18 | ||||||
| 残存率(%) | - | 100.4 | 100.4 | 100.4 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3 ブスコパン注 20mg タガメット注射液 200mg |
太陽ファルマアスペンジャパン サノフィ 大日本住友製薬 |
1mg/mL +9.9mg/3mL +20mg/mL +200mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.42 | 6.42 | 6.42 | 6.41 | ||||||
| 残存率(%) | - | 100.4 | 100.4 | 100.4 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3 ブスコパン注 20mg タガメット注射液 200mg |
太陽ファルマアスペンジャパン サノフィ 大日本住友製薬 |
3mg/3mL +9.9mg/3mL +20mg/mL +200mg/2mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.40 | 6.39 | 6.39 | 6.39 | ||||||
| 残存率(%) | - | 100.9 | 100.4 | 100.4 | ||||||
| アロキシ静注 0.75mg デカドロン注射液 3.3mg × 3 アタラックス-P 注射液(50mg/mL)ブスコパン注 20mg |
大鵬薬品工業アスペンジャパン ファイザーサノフィ |
0.75mg/5mL +9.9mg/3mL +50mg/mL +20mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.36 | 6.39 | 6.38 | 6.39 | ||||||
| 残存率(%) | - | 100.0 | 100.4 | 100.4 | ||||||
| アロキシ点滴静注バッグ 0.75mg デカドロン注射液 3.3mg × 3 アタラックス-P 注射液(50mg/mL)ブスコパン注 20mg |
大鵬薬品工業アスペンジャパン ファイザーサノフィ |
0.75mg/50mL +9.9mg/3mL +50mg/mL +20mg/mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.32 | 6.32 | 6.32 | 6.29 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 100.4 | ||||||
| カイトリル注 1mg デカドロン注射液 3.3mg × 3 アタラックス-P 注射液(50mg/mL)ブスコパン注 20mg |
太陽ファルマアスペンジャパン ファイザーサノフィ |
1mg/mL +9.9mg/3mL +50mg/mL +20mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 7.03 | 7.03 | 7.03 | 7.02 | ||||||
| 残存率(%) | - | 100.4 | 100.4 | 100.4 | ||||||
| カイトリル注 3mg デカドロン注射液 3.3mg × 3 アタラックス-P 注射液(50mg/mL)ブスコパン注 20mg |
太陽ファルマアスペンジャパン ファイザーサノフィ |
3mg/3mL +9.9mg/3mL +50mg/mL +20mg/mL +Sal. 100mL |
性状 | 無色澄明 | 無色澄明 | 無色澄明 | 無色澄明 | |||
| pH | 6.94 | 6.94 | 6.94 | 6.93 | ||||||
| 残存率(%) | - | 100.0 | 100.0 | 100.4 | ||||||
一方、類似薬のアプレピタントはパロノセトロンと混合して投与できません。(3時間で分解物の増加が認められ、析出の可能性がある)※アプレピタント配合変化表⇓
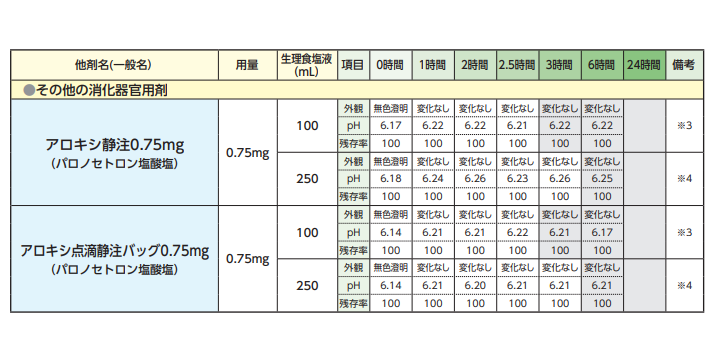
ですので、アロカリスはパロノセトロンと混合して投与することができるので投与時間を短縮できるというメリットがあります。
ただし、パロノセトロンとアプレピタントを混合後すぐに投与すれば問題ない(3時間以内なら分解物は認められない)ため、そこまで大きなメリットにはならないようにも思います。
アロカリスは配合変化は多いので、配合変化を調べるにはこちらが便利です⇓
アロカリスの配合変化データをデータベースし、簡単に検索できる検察ツール公開中
アプレピタントとアロカリスで優先順位は?ガイドラインではどうなっているか?
ASCOのガイドラインを参考にすると、NK1受容体拮抗薬として同列で挙げられているのでアプレピタントとアロカリスで優先順位に差はないです。
参考:https://www.asco.org/sites/new-www.asco.org/files/content-files/advocacy-and-policy/documents/2020-Antiemetic-Dosing-Clinical-Tool%20%281%29.pdf
アロカリスとホスアプレピタントのコストを比較すると?
薬価で比較すると、このようになっています。
| 医薬品名 | プロイメンド(先発品) | ホスアプレピタント(後発品) | アロカリス |
| 薬価 | 11,276円 | 5,734円 | 11,276円 |
また、薬価差益はどの薬剤でも3千円くらい(?)で薬剤間で差がないと言われています。
⇒つまり、DPCの病院では単純に購入価格の安い「ホスアプレピタント(後発品)」を使ったほうが病院経営上は有利となります。
著者の感想
注射部位反応を重要視するならアロカリスを使用したほうが良いですが、有効性に差がないため病院経営上有利な方(おそらくホスアプレピタントの方が有利)を使用するというのもありかと思います。
医薬品の薬剤コストの計算や考え方については別の記事で詳しく解説しています。


















